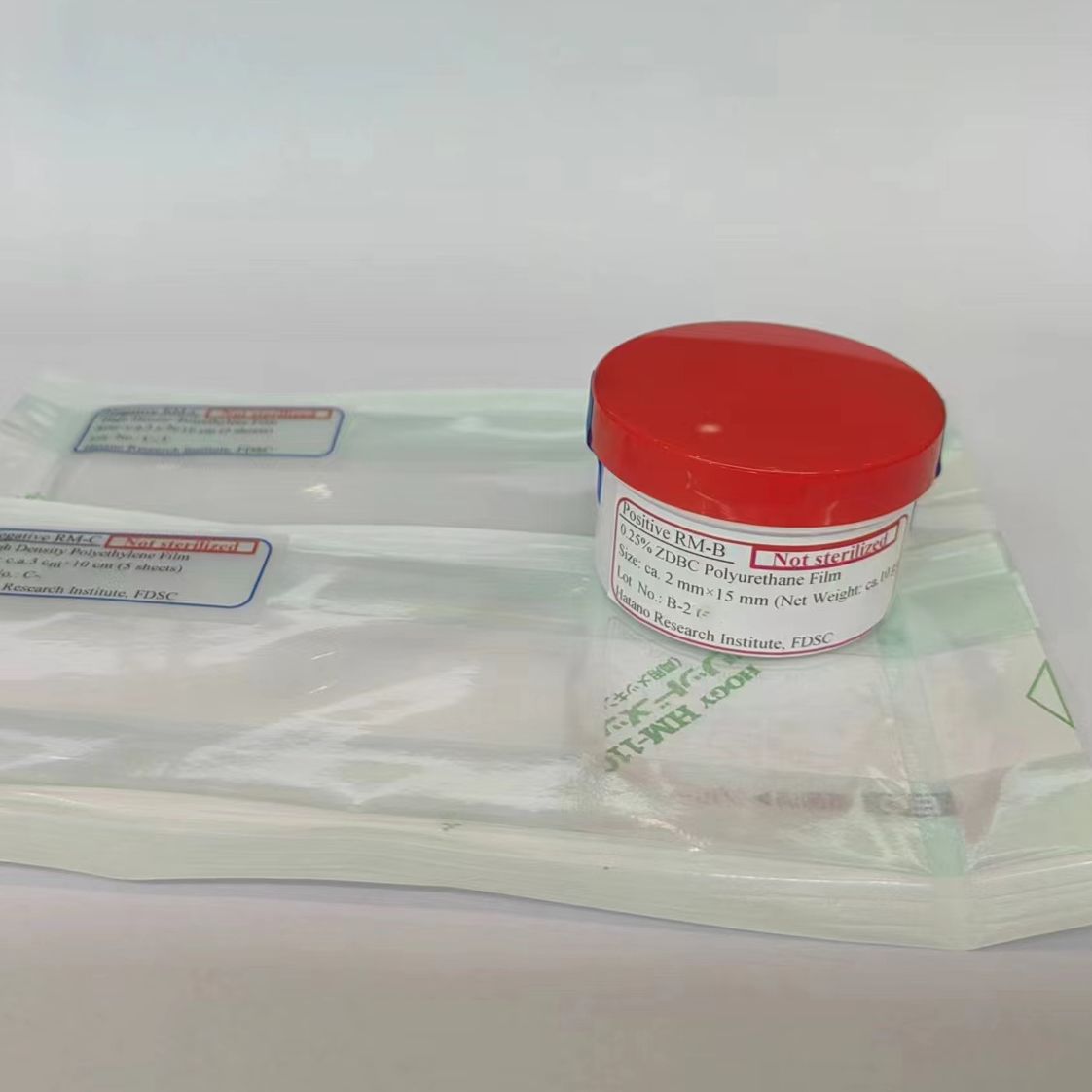
体外细胞毒性试验阳性对照品由Hatano Research institute (HRI) 研究生产,广泛应用于体外细胞毒性实验,可以满足中国药典-细胞毒性检查方法、ISO 10993和YBB 00012003细胞毒性检查法的参数要求。
体外细胞毒性试验阳性对照品使用常规培养基进行浸提。浸提方法如下:无菌操作,取1g体外细胞毒性试验阳性对照品放置于15mL无菌离心管中,按照3mL/g浸提比例加入浸提介质培养基,水平放置振荡,120rpm,37℃条件下浸提24h。浸提结束后上下颠倒混匀10次,取浸提液用于试验。浸提所用的培养基作为空白对照。注意配制好的培养基在4℃条件下贮存不超过两周。体外细胞毒性试验采用MTT法进行检测:取状态良好的L929细胞,消化离心,配制成细胞悬液,接种于96孔培养板。每组设立多个复孔,每孔接种100µL细胞悬液,置37℃、5%二氧化碳的CO2培养箱培养24h。弃去原培养基,加入100µL浸提液、空白对照液,于CO2培养箱继续培养。24h后,于显微镜下观察细胞形态。弃去孔内液体,每孔加入50µL1mg/mL的无菌MTT溶液(MTT用MEM培养基配置,现用现配,不可用培养基配制),继续培养2h后弃去孔内液体,加入100µL异丙醇,振荡混匀,在570nm和650nm波长下测定吸光度,计算细胞存活率。
细胞毒性试验是利用体外细胞培养的方法评价生物材料或浸提液潜在的细胞毒性,是生物材料生物学评价体系中重要的测定指标之一,也是几乎各种用途的生物材料必须进行检测的项目。细胞毒性试验能在短期内测试生物材料对细胞代谢功能的影响,可以快速筛选材料是否具有潜在的细胞毒性。
细胞毒性试验作为检测生物材料毒性的手段,具有简便、敏感性高、成本低、试验周期短等优点,广泛用于生物材料产品的生物相容性检测和评价手段。对生物材料细胞毒性的评价方法从观察细胞的形态和数量变化,发展到对细胞的粘附、增殖、代谢等方面的评价,以有活力的细胞数和细胞增殖能力作为评价生物材料细胞生物相容性的评价方法。具体的试验有中性红摄取试验、克隆形成试验、MTT细胞毒性试验和XTT细胞毒性试验等方法,其中以MTT和XTT细胞毒性试验方法,由于可以定量测定材料的细胞毒性,因此更为被大家接受并且应用也更为广泛。
MTT和XTT细胞毒性试验检测原理为活细胞线粒体中琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲臢(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)或异丙醇或吩嗪硫酸甲酯(PMS)能溶解细胞中的甲臢结晶,用酶标仪在570nm波长处测定其光吸收值,在一定细胞数范围内,结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强,毒性越小。通过计算细胞的增殖率,可以定量分级评价医用材料及其制品的细胞毒性。也可以通过浸提液的不同浓度稀释情况下细胞的存活度计算IC50(细胞活度抑制50%的浓度),评价生物材料及其制品的细胞毒性。
体外细胞毒性试验阳性对照品具有批次重现性好,性能稳定、规格大小丰富的特点,可以作为生物学评价-细胞毒性测定的理想材料。

 扫一扫,手机浏览
扫一扫,手机浏览